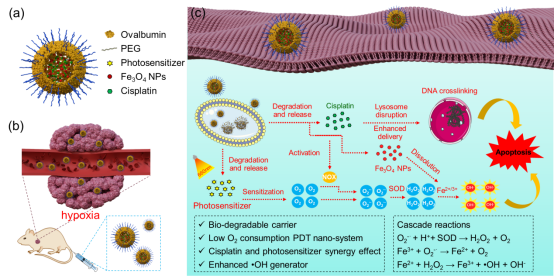
光动力疗法(PDT)是用光敏药物和激光活化治疗肿瘤疾病的一种新方法,具有高效精准、毒副作用小等特点。然而,肿瘤内部通常为缺氧环境,极大的限制了PDT效率。此外,缺氧还会进一步加剧肿瘤细胞耐药性,降低化疗效果。为克服这一难题,大连理工大学樊江莉教授、孙文副研究员,联合德国马普高分子研究所Katharina Landfester教授报道了由卵清蛋白封装介导的串联Fenton反应发生器,通过增强的活性氧(ROS)生成机制改善对体内低氧耐药肿瘤的治疗,实现了协同PDT /化学疗法。
可生物降解的卵清纳米胶囊包含I型光动力光敏剂(NBS),顺铂药物和用于芬顿(Fenton)反应的Fe3O4纳米颗粒。通过条件优化,上述三种功能试剂均可包裹于卵清纳米粒子内部,并展现出很高的共包封效率。即使在严格的低氧环境下(2% O2),光敏剂NBS仍具有优异的I型PDT功效。即在光照下,PDT产生超氧阴离子,并在超氧化物歧化酶(SOD)的催化下转化为H2O2,然后经Fe3O4纳米颗粒介导的芬顿反应过程中转化为剧毒的•OH同时释放O2。因而,该过程可实现氧气的循环利用,克服缺氧对PDT效率的影响。另外,PDT过程促进了药物(顺铂,临床抗癌药)的溶酶体逃逸,使抗癌药物高效向核内递送。同时,在烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)的存在下,顺铂也会产生超氧阴离子,可起到补充•OH的作用进一步以提高治疗效率。由于PDT与化疗的协同作用,该卵清蛋白纳米颗粒在缺氧耐药肿瘤的治疗中展现出优异的效果。这一策略有望用于增强抗癌治疗。
以上相关成果发表在化学领域Top期刊Angewandte Chemie International Edition,并被选为Hot paper。论文的第一作者为博士后姜帅和硕士毕业生肖明,大连理工大学为论文的第一通讯单位。该研究得到了国家自然科学基金(21925802, 21808028)、大连理工大学启动基金(2019-BS-047)等经费的支持。
全文链接: